Mis licencias

Este obra está bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 3.0 Unported.
sábado, 6 de abril de 2013
domingo, 24 de marzo de 2013
"Referencias de las imágenes de la cabecera"
Las ciencias al derecho y al revés (2010). “Breve historia
de la química”. Consultado en: http://beregillcervantes.blogspot.mx/2010/08/breve-historia-de-la-quimica.html
Mediateca (Febrero del 2007) “Tubo de ensayo”. Consultado en:
http://mediateca.educa.madrid.org/imagen/ver.php?id_imagen=z97mhw6vruvx2zdi
Clckr.com ( Noviembre del 2007) “Fire icon”. Conslutado en:
Extensivo Terceirão (Octubre del 2010) “ Um novo teste de conhecimiento em química espera por você na página de testes. Consultado en: http://www.coopermundi.com.br/terceirao/notindividual.asp?id=76
El Favicon fue hecho por mí, representando vagamente un matraz, ojalá se pueda apreciar.
sábado, 16 de marzo de 2013
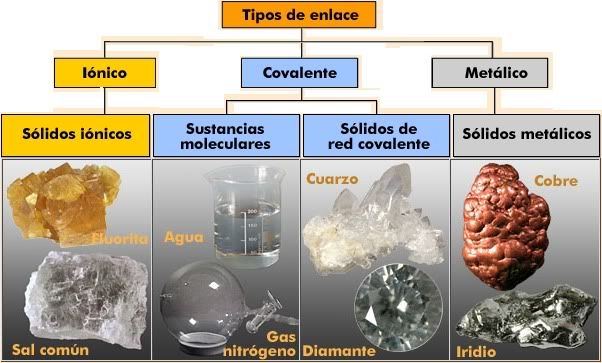
Práctica 3.- Propiedades químicas de los compuestos iónicos y covalentes.
Objetivo.
Comparar experimentalmete las
propiedades de los compuestos iónicos y covalentes.
Técnica o procedimiento.
-Utilizando un circuito,
determine la conectividad eléctrica de las siguientes sustancias: NaCl, KNO3(s), CuSO4.5H2O(s),
C12H22O11(s)(Sacarosa), C (Gafito).
-Utilizando un circuito,
determine la conductividad eléctrica introduciendo los electrodos en las
siguientes soluciones: NaCl, KNO3, CuSO4, sacarosa, almidón, CH3-COOH, HCl, H2O
destilada y H2O de la llave.
-En tres tubos de ensaye de 18 x
150 mm, coloque una pequeña porción de ácido benzoico. Al primer tubo agregue 3
mL de H2O destilada, al segundo 3 mL de etanol y al último 3 mL de hexano.
Agite suavemente para ver si el ácido benzoico se disuelve. Repita esa misma
operación para cada una de las siguientes sustancias CuSO4.5H2O, NaCl y
vaselina.
-En tres tubos de
ensaye de 18 x 150 mm, coloque en cada uno de ellos 3 g de NaCl, CuSO.5H2O y
H2O. Con la ayuda de pinzas para tubos de ensaye, llévelos a la flama del mechero,
procurando que todas las muestras reciban el mismo calor. En una cucharilla de
ignición tome almidón y colóquelo sobre la flama del mechero.
Resultados.
Se comprobaron la conductibilidad
de varias soluciones y sólidos a utilizar y quedó así:
Cloruro de sodio: No enciende
solo, pero ya en solución conduce sin problemas.
El cúprico de azufre no demostró
conductibilidad en el estado sólido.
El azúcar no condujo la
corriente, en lo absoluto.
 |
| Imagen de dominio público |
El almidón en estado
sólido no conduce por sí solo, pero en solución líquida lo hace vagamente.
El ácido benzoico conduce muy
poco.
La sacarosa no
conduce.
El ácido clorhídrico conduce muy
bien.
El agua de la llave es muy poco
conductora, en cambio el agua destilada conduce nada en absoluto.
Observaciones y
conclusiones.
En ésta práctica aprendimos y
experimentamos con electro conductividad de soluciones y como afecta en su
estado éste atributo. Los atributos en distintos estados de la materia y los
cambios que presentan como la ya antes mencionada conductividad e incluso el
cambio de color como en el sulfato de cobre, pudiendo apreciar en parte algunas
de las diferencias entre enlaces iónicos y covalentes.
A mi parecer, el
entendimiento de los enlaces no sólo es en base a experimentos, aunque
carecemos de actualización en ello, resulta útil en gran medida adelantar éste
proceso para su posterior conocimiento. El cambio de apariencia, consistencia y
conductividad en las distintas soluciones, así como la variante de agua
destilada y de la llave indica que los componentes de las soluciones puede
hacer que el resultado varíe, como las sales y demás que el agua de la llave
posee y el agua ya destilada carece, todo es cuestión de indagar más, conocer a
fondo lo que está a tratar, uno puede encontrarse con un mundo de reacciones si
se adentra más a ello. Conclusión, es fascinante saber que en cada reacción
existe una diferencia de compuesto a otro, resultando en distintas variantes
que algo casi igual puede causar, en mi opinión, digno de investigarse e
instruirse en él.
Respuestas al cuestionario.
1.- Con base en los resultados
obtenidos, señale cuáles sustancias son iónicas y cuales covalentes.
- Iónicas: Cloruro de sodio,
sulfato cúprico, almidón y el nitrato de potasio.
Covalentes: La sacarosa, el
azúcar.
2.- ¿Por qué el grafito sí
conduce la corriente eléctrica?
-El grafito tiene una estructura
atómica de láminas de carbono en las que seis átomos de carbono forman una
estructura hexagonal, cada carbono tiene cuatro electrones libres, pero sólo
tres de ellos se utilizan para enlazarse covalentemente con los carbonos
vecinos. Por tanto queda un electrón libre por átomo para la conducción de
electricidad
3.- Si tuviera HCl puro,
¿Conduciría la corriente eléctrica?, ¿Por qué? Si el HCl se disolviera en
hexano, ¿conduciría la electricidad? ¿Por qué?
A.-) Si, porque es un ácido muy
fuerte y se disocia completamente en agua y eso hace que sea fuertemente
electrilitico o conductor de electricidad.
B.-) Pues, el hexano se
comportaría como un solvente apolar y no influiría en la disociación del HCl.
El hexano por si solo no es conductor de electricidad, porque no es
electrolito. Aún así, el hexano podría presentar una moderada solvatación a los
iones, con lo que la conductividad sería quizás nula.
4.- ¿Cuál fue la solución
mejor conductora de la electricidad y cuál la peor?
-El cloruro de sodio en agua es
la mejor, por otra parte, el azúcar es la peor conductora, ya que no tiene
partículas cargadas, iones, y por lo tanto al disolverse e el agua no conduce
electricidad.
5.- En el paso 4, ¿Cuál
sustancia tiene el más bajo punto de fusión y cuál el más alto?
-Sulfato de cobre 110°C es el de
menor punto de fusión y el cloruro de sodio 801°C es el de mayor punto de
fusión.
6.- Coloque en orden las
soluciones de mayor a menor conductividad eléctrica.
-Cloruro de sodio, ácido clorhídrico,
nitrato de potasio, agua de la llave, ácido benzoico y el almidón.
Fuentes:
http://www.rena.edu.ve/cuartaEtapa/quimica/Tema7.html
Fuentes:
http://www.rena.edu.ve/cuartaEtapa/quimica/Tema7.html
Práctica 2.- La coloración de la llama
Objetivo.
Identificar elementos químicos
mediante la observación de la coloración de la flama en reacción con los
químicos impregnados.
Técnica o procedimiento.
-En un vaso de precipitado de 50
ml. Vierta un volumen de 5 ml. De HCl 6 M y tapar con un vidrio de reloj.
 |
| fotografía de dominio público |
-Se utilizó el alambre de platino
al limpiarlo en ácido y llevándose a la flama. Se repite hasta que la flama sea
de color ámbar o natural de ésta.
-Con el alambre se toma un poco
de la muestra del cloruro de sodio, después de producir la llama se va con los
demás que son el cloruro de cobre, el cloruro de litio, cloruro de calcio,
cloruro de potasio, bario y estroncio, cada uno produciendo las flamas que a
continuación de describirán.
Resultados.
Como era de esperar,
se quería demostrar los diferentes colores y reacciones que muestran las sales
en conjunto con ácido clorhídrico y fuego, y éstos fueron los resultdos:
Cloruro de cobre.- Se
produce una llama verde azulada.
Cloruro de sodio.- La
llama se presentaba Ámbar.
Cloruro de litio.- De un
color rojo carmín.
Cloruro de calcio.- De
rojo e inicio verde.
Cloruro de potasio.- Se
presentó morada
Cloruro de bario.-
Amarillo en el inicio y verde en la llama.
Cloruro de estroncio.- Se
presentó por poco tiempo rojo, pasó a ser ámbar.
Observaciones y conclusiones.
Las distintas reacciones químicas
que pueden presentar los cuerpos, elementos y compuestos van más allá de burbujas
en un frasco o descomposición más allá, las reacciones químicas componen una
gran gamma de sucesos y eventos que difícilmente podremos todos ver, tocar o
experimentar como éste. Las diferentes reacciones de cada bases emiten un color
diferente por su duración, en cómo se enmascaran con la reacción de otro
elemento, simplemente alucinante.
Respuestas al cuestionario.
-Defina los siguientes términos: Átomo normal, átomo excitado, ión,
ondas electromagnéticas, fotón.
Un átomo normal ó en estado
basal.- sus electrones se ubican lo más cerca que pueden del núcleo,
siempre de forma ordenada.
Un átomo excitado.- es el
que ha absorbido energía y sus electrones se han movido a un nivel de mayor
energía (se han alejado del núcleo).
Ión.- átomo o
grupo de átomos que tienen una carga eléctrica.
Ondas
electromagnéticas.- Es un tipo de radiación en forma de onda
que se caracteriza por poseer dos campos: Un campo eléctrico y otro campo
magnético, oscilando perpendicularmente entre sí.
Fotón.- partícula elemental, compuesta de luz. Esto quiere decir que
el fotón es la partícula más pequeña de la que está compuesta la luz. Por
consiguiente podría decirse que el fotón es energía pura, además de que no
tiene masa.
-describa las características que se observarían al realizar la
prueba a la flama utilizando un espectroscopio.
En el Coluro de Sodio aparece oscuro en el que predomina el
naranja, seguido del verde y después el morado.
En el Sulfato de Cobre aparecen los colores naranja, amarillo,
verde y morado.
El Cloruro de Estroncio cuenta con los colores, rojo, naranja,
amarillo, verde, morado.
Sólo por mencionar los básicos y llamativos.
-Explique en que consisten los espectros de emisión continuos y
discontinuos.
Continuos.- obtienen a
partir de la radiación emitida directamente sobre el cuerpo. Los espectros de
emisión continuos se obtienen al pasar la luz de un cuerpo incandescente a
través de un prisma óptico
Discontinuos.- los
producen gases o vapores a elevada temperatura.
-Describa el modelo de funcionamiento del mechero bunsen y
especifique que rangos de temperatura alcanza.
El quemador tiene una base pesada
en la que se introduce el suministro de gas. De allí parte un tubo vertical por
el que el gas fluye atravesando un pequeño agujero en el fondo de tubo. Algunas
perforaciones en los laterales del tubo permiten la entrada de aire en el flujo
de gas (gracias al efecto Venturi) proporcionando una mezcla inflamable a la
salida de los gases en la parte superior del tubo dónde se produce la
combustión de éste mismo.
La cantidad de gas y por lo tanto de calor de la llama puede controlarse ajustando el tamaño del agujero en la base del tubo. Si se permite el paso de más aire para su mezcla con el gas la llama arde a mayor temperatura (apareciendo con un color azul). Si los agujeros laterales están cerrados el gas solo se mezcla con el oxígeno atmosférico en el punto superior de la combustión ardiendo con menor eficacia y produciendo una llama de temperatura más fría y color rojizo o amarillento. Cuando el quemador se ajusta para producir llamas de alta temperatura éstas, de color azulado, pueden llegar a ser invisibles contra un fondo uniforme.
La cantidad de gas y por lo tanto de calor de la llama puede controlarse ajustando el tamaño del agujero en la base del tubo. Si se permite el paso de más aire para su mezcla con el gas la llama arde a mayor temperatura (apareciendo con un color azul). Si los agujeros laterales están cerrados el gas solo se mezcla con el oxígeno atmosférico en el punto superior de la combustión ardiendo con menor eficacia y produciendo una llama de temperatura más fría y color rojizo o amarillento. Cuando el quemador se ajusta para producir llamas de alta temperatura éstas, de color azulado, pueden llegar a ser invisibles contra un fondo uniforme.
-¿A qué se le llama espectro de absorción?
Se obtiene cuando se hace pasar a
través de un gas la luz de un cuerpo llevado a la incandescencia y está
caracterizado por líneas negras, llamadas líneas de absorción, que acompañan al
espectro en la misma posición en la que el propio gas habría producido las
líneas de emisión.
-Describa el espectro electromagnético (Desde la onda larga de radio
hasta las radiaciones cósmicas.)
Distribución que tienen las
distintas longitudes de ondas, partiendo desde las mas bajas que son las ondas
de radio, hasta los rayos gamma y cósmicos
Todas las ondas electromagnéticas son campos móviles de fuerza eléctrica y magnética.
Fuentes: http://www.ensaimadamalabar.com/fuegocolores.htm
Todas las ondas electromagnéticas son campos móviles de fuerza eléctrica y magnética.
Fuentes: http://www.ensaimadamalabar.com/fuegocolores.htm
Práctica 1.- Métodos de separación de mezclas
Objetivo.
Adquirir conocimientos básicos
sobre y para la separación por métodos físicos y químicos de los componentes de
una mezcla.
Técnica o procedimiento.
Se le agregó 150
mililitros de agua destilada a un vaso de precipitado. Después se le agregó 5
gramos de cloruro de sodio a cada uno de los vasos y con un abate lenguas se le
agrega un poco de arena fina.
La sal se ha disuelto pero la
arena poco a poco se queda en el fondo como sedimento, esto es la
sedimentación.
El agua que quedó sin
sedimentar después de cinco minutos se pasa 40 mililitros a tres pequeños vasos
de precipitado. Haremos la segunda
separación, esta será por filtrado a través de filtros de papel y se hace el
filtrado en un vaso de precipitado de 250 mililitros.
Los sólidos que
quedaron disueltos en el agua se pegan a las paredes del filtro y el agua pasa
a través aparentemente clara y limpia.
Por filtración al
vacío será el otro vaso, se remueven las sales del segundo vaso al introducirla
a un embudo, el cual pasa a través del sistema de filtrado, gasificando el agua
que sale por el otro y dejando las sales en el primero.
Por pipeta pasaremos a uno de los
pequeños 3 mililitros de agua mezclada por pipeta a tres tubos de ensayo.
Posteriormente, las mezclas depositadas se introducen a la centrífuga y al
término del minuto pasado, a tres mil revoluciones por minuto, las sales se han
depositado en el fondo del tubo, el agua ha quedado encima, ahora ha tenido
lugar la separación por decantación.
Se utilizan cinco
mililitros del primer filtrado y se enciende el mechero y se coloca bajo el
vaso qué a su vez se coloca en un tripié, pero no sobre un fuego directo, sino
sobre una plataforma especial que deje pasar el calor suficiente para su
ebullición.
Al empezar a burbujear se retira un poco de la
flama, lo suficiente para que no se dañe el equipo y éste siga calentándose. Al
evaporarse el agua, las sales quedan pegadas en las paredes inferiores del
vaso, ahora con el agua totalmente filtrada y libre de sales, pues estas no
pasaron a su forma gaseosa.
De la primera muestra disuelta,
se le agregan ocho gotitas de nitrato de plata, se precipita dejándolo en el
fondo y algunas partes de la orilla, otra filtración exitosa.
Resultados.
En cada uno de los experimentos,
el resultado tenía que ser la exitosa filtración y separación de mezclas por
métodos físicos y, aunque no haya sido terminada o bien, dejada a medias, el
mero hecho de avanzar nos deja en claro que la práctica va a eso, seguir con
las separaciones.
Así como hay distintos y variados
métodos para mezclar y todo lo que en cuenta se ha de tomar a la hora de
solubilizar alguna sustancia en líquidos o cualquier otro material, hay un
método de separación al punto, es decir, uno que le vendrá mejor a la hora,
puesto que en algunos casos no se separó correctamente y fue necesario usar
otro más para separarlo por completo, igual, ninguno es lo suficientemente
fuerte o preciso para separar cada elemento de la mezcla, conclusión, para
distintos tipos de mezclas hay variados sistemas de separación y experimentar
con ellos nos hace comprender en como formar y deformar lo que nos interese
hacer.
Respuestas al cuestionario.
1.-En qué consiste casa uno de los diferentes métodos de separación
utilizados en el experimento?
Decantación.- Separación de grano grueso que se solubiliza en un
líquido dejando que se sedimente en el fondo.
Filtración.- Separación de objetos insolubles la cual pasan por un
medio que es más pequeño que las partículas que se buscan filtrar, dejando
pasar el de menor tamaño entre ella, pero dejando al de mayor encima de ésta.
Evaporación.- Método por el que el líquido se hierve a temperatura
suficiente para evaporarlo, dejando tras él lo solubilizado en el agua.
Centrifugación.- La mezcla se ve aplicada a altas revoluciones,
haciendo que lo que se mezclo en el líquido quede en el fondo de la muestra, en
este caso un tubo de ensayo.
Filtrado al vacío.- separación de mezclas en líquido. La mezcla se introduce en
un embudo con el papel de filtro puesto en éste.q
Desde el fondo del embudo se aplica con una bomba un vacío que succiona la
mezcla, quedando el sólido atrapado entre los poros del filtro.
2.-Qué es una mezcla?
Es un conjunto de dos o más
sustancias que no están combinadas químicamente. No ocurre reacción química y
es posible separar ambas sustancias de la mezcla original.
3.-Existen mezclas sólida, gaseosas y líquidas. Las mezclas en estado
intermedio constituyen los sistemas de dispersión y estos son coloidales y
suspensiones. Mencione cuatro ejemplos de cada una de las mezclas y de sistemas
de dispersión.
Gaseosa.- El oxígeno disuelto en el aire con otros elementos, la
niebla que es en su mayoría el compuesto agua, el polvo de casa y el humo, una
mezcla de carbón.
Líquida.- Leche que es calcio casi toda, sangre que está compuesta
por varios elementos, el jugo de frutas y las pinturas vinílicas son también
además de mezclas en las que muchos elementos toman parte.
Sólida.- Piedra pómez, el queso que es en su mayoría calcio, la
mantequilla que al igual que el queso es mayormente calcio y las piedras
preciosas pintadas.
Coloidales.- Espuma de afeitar, gelatina, crema humectante de piel
y tinta china.
Suspensiones.- El anti diarreico por el caolín en polvo, los
antiácidos, crema para el café y la penicilina inyectable.
4.-Mencione los tipos de filtros más comunes utilizados en un
laboratorio.
Filtros de gravedad, filtros de
presión, filtros de cámaras y filtros de bastidores.
5.-Mencione los tipos de destilación más comunes.
La Destilación
Simple, Destilación Fraccionada y la Destilación por Arrastre con Vapor.
6.-Qué otros métodos de separación existen?
Cromatografía en papel, pulverización,
cristalización y sublimación.
Suscribirse a:
Comentarios (Atom)

